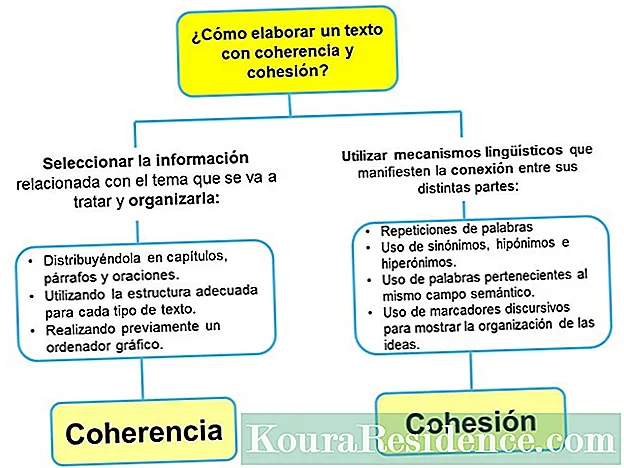
உள்ளடக்கம்
- உலோகங்கள் மற்றும் அல்லாத உலோகங்களுக்கு இடையிலான வேறுபாடுகள்
- உலோகங்களின் எடுத்துக்காட்டுகள்
- அல்லாத உலோகங்களின் எடுத்துக்காட்டுகள்
அறியப்பட்ட அனைத்து விஷயங்களும் உருவாக்கப்பட்டுள்ளன அணுக்கள், 112 இலிருந்து இரசாயன கூறுகள் அது உருவாக்குகிறது தனிம அட்டவணை. இந்த கூறுகள் அவற்றின் இயல்பு மற்றும் பண்புகளுக்கு ஏற்ப வகைப்படுத்தப்பட்டுள்ளன உலோகங்கள் மற்றும் உலோகங்கள் அல்லாதவை.
112 உறுப்புகளில் 25 மட்டுமே உலோகம், பொதுவாக இருந்து வருகின்றன தாதுக்கள் மற்றும் கனிம வேதியியலால் முழுமையாக ஆய்வு செய்யப்பட்ட மின் பண்புகள் மற்றும் தொடர்புகளுடன். மறுபுறம், மீதமுள்ள கூறுகள், உலோகம் அல்லாதவை, வாழ்க்கைக்கு அவசியமானவை மற்றும் அறியப்பட்ட கரிமப் பொருட்களின் வெவ்வேறு வடிவங்களை உருவாக்குகின்றன.
உலோகங்கள் மற்றும் அல்லாத உலோகங்களுக்கு இடையிலான வேறுபாடுகள்
உலோகங்கள் மற்றும் உலோகங்கள் அல்லாதவை அவற்றின் அடிப்படை பண்புகளில் வேறுபடுகின்றன மற்றும் அவற்றின் சாத்தியமான எதிர்வினைகள்.
- தி உலோகங்கள் அவை, பாதரசத்தைத் தவிர, அறை வெப்பநிலையில் திடப்பொருள்கள். அவை பளபளப்பானவை, அதிகமாகவோ அல்லது குறைவாகவோ இருக்கும் நீர்த்துப்போகக்கூடிய மற்றும் இணக்கமான, அவை நல்லவை மின்சாரம் மற்றும் வெப்பத்தின் கடத்திகள். ஆக்ஸிஜன் அல்லது அமிலங்களுடன் தொடர்பு கொள்ளும்போது, அவை வெளிப்புற அடுக்குகளில் எலக்ட்ரான்கள் (3 அல்லது அதற்கும் குறைவாக) குறைவாக இருப்பதால் அவை ஆக்ஸிஜனேற்றப்பட்டு அழிக்கப்படுகின்றன (எலக்ட்ரான்களின் இழப்பு).
- தி உலோகங்கள் இல்லைஅதற்கு பதிலாக, அவை வழக்கமாக இருக்கும் மின்சாரம் மற்றும் வெப்பத்தின் மோசமான கடத்திகள், மிகவும் மாறுபட்ட தோற்றங்கள் மற்றும் உருகும் புள்ளிகள் பொதுவாக உலோகங்களுக்கு கீழே. பல பயோடோமிக் (மூலக்கூறு) சூத்திரத்தில் மட்டுமே உள்ளன, அவை கந்தகத்தைப் போல மென்மையாகவோ அல்லது வைரத்தைப் போல கடினமாகவோ இருக்கலாம், மேலும் அவை மூன்று மாநிலங்களில் ஏதேனும் ஒன்றில் காணப்படுகின்றன: வாயு, திரவ மற்றும் திட. மேலும், அவற்றின் தோற்றம் பொதுவாக ஒளியைப் பிரதிபலிக்காது, மேலும் அவை வெவ்வேறு வண்ணங்களைக் கொண்டிருக்கலாம்.
கடைசியாக, உலோகக் கூறுகள் பொதுவாக மின்காந்த உறவுகளால் (சார்ஜ் செய்யப்பட்ட அயனிகள்) ஒன்றிணைக்கப்படுகின்றன, அதே நேரத்தில் உலோகம் அல்லாத கூறுகள் பல்வேறு வகையான (ஹைட்ரஜன், பெப்டைட் போன்றவை) பிணைப்புகள் மூலம் சிக்கலான மூலக்கூறு கட்டமைப்புகளை உருவாக்குகின்றன. எனவே கரிம வேதியியல் அல்லது வாழ்க்கை என்பது பிந்தையது, இருப்பினும் உயிருள்ள உடல்கள் இரண்டு வகையான உறுப்புகளின் சேர்க்கைகளால் ஆனவை.
உலோகங்களின் எடுத்துக்காட்டுகள்
- இரும்பு (Fe). என்றும் அழைக்கப்படுகிறது இரும்புஇது பூமியின் மேலோட்டத்தில் மிகுதியாக இருக்கும் உலோகங்களில் ஒன்றாகும், இது கிரகத்தின் இதயத்தை உருவாக்குகிறது, அங்கு அது திரவ நிலையில் உள்ளது. அதன் கடினத்தன்மை மற்றும் உடையக்கூடிய தன்மை தவிர, அதன் மிகச் சிறந்த சொத்து, அதன் பெரிய ஃபெரோ காந்த திறன் ஆகும். கார்பனுடன் கலப்பதன் மூலம் எஃகு பெற முடியும்.
- மெக்னீசியம் (Mg). பூமியில் மூன்றாவது மிகுதியான உறுப்பு, அதன் மேலோட்டத்திலும், கடல்களில் கரைந்தாலும், இது இயற்கையில் ஒருபோதும் ஏற்படாது தூய நிலை, ஆனால் உப்புகளில் அயனிகளாக. இது வாழ்க்கைக்கு இன்றியமையாதது, உலோகக் கலவைகளுக்குப் பொருந்தக்கூடியது மற்றும் அதிக எரியக்கூடியது.
- தங்கம் (Au). ஒரு பிரகாசமான, மென்மையான மஞ்சள் விலைமதிப்பற்ற உலோகம் பெரும்பாலானவற்றோடு வினைபுரியாது இரசாயன பொருட்கள் சயனைடு, பாதரசம், குளோரின் மற்றும் ப்ளீச் தவிர. வரலாறு முழுவதும் இது மனித பொருளாதார கலாச்சாரத்தில் ஒரு முக்கிய பங்கைக் கொண்டிருந்தது, செல்வத்தின் அடையாளமாகவும் நாணயங்களுக்கான ஆதரவாகவும்.
- வெள்ளி (ஆக). மற்றொரு விலைமதிப்பற்ற உலோகம் வெள்ளை, பிரகாசமான, நீர்த்துப்போகக்கூடியது மற்றும் இணக்கமானது, இது இயற்கையில் பல்வேறு தாதுக்களின் ஒரு பகுதியாக அல்லது தனிமத்தின் தூய தண்டுகளாக காணப்படுகிறது, ஏனெனில் இது பூமியின் மேலோட்டத்தில் மிகவும் பொதுவானது. வெப்பம் மற்றும் மின்சாரம் அறியப்பட்ட சிறந்த நடத்துனர் இது.
- அலுமினியம் (அல்). மிகவும் ஒளி, ஃபெரோ காந்த உலோகம், பூமியின் மேலோட்டத்தில் மூன்றாவது மிகுதியானது. தொழில்துறை மற்றும் இரும்பு மற்றும் எஃகு வர்த்தகங்களில் இது மிகவும் மதிப்பு வாய்ந்தது, ஏனெனில் உலோகக் கலவைகள் மூலம் அதிக எதிர்ப்பின் மாறுபாடுகளைப் பெற முடியும், ஆனால் அவை அவற்றின் பன்முகத்தன்மையைத் தக்கவைத்துக்கொள்கின்றன. குறைவாக உள்ளது அடர்த்தி மற்றும் அரிப்புக்கு நல்ல எதிர்ப்பு.
- நிக்கல் (நி). மிகவும் வெள்ளை உலோகம் ductile மற்றும் மிகவும் இணக்கமான, மின்சாரம் மற்றும் வெப்பத்தின் ஒரு நல்ல நடத்துனர், அத்துடன் ஃபெரோ காந்தமாக இருப்பது. இரிடியம், ஆஸ்மியம் மற்றும் இரும்பு ஆகியவற்றுடன் அடர்த்தியான உலோகங்களில் இதுவும் ஒன்றாகும். இது பலருக்கு ஒரு பகுதியாக இருப்பதால், அது வாழ்க்கைக்கு இன்றியமையாதது என்சைம்கள் ஒய் புரத.
- துத்தநாகம் (Zn). இது காட்மியம் மற்றும் மெக்னீசியம் போன்ற ஒரு இடைநிலை உலோகமாகும், இது பெரும்பாலும் கால்வனிங் செயல்முறைகளில் பயன்படுத்தப்படுகிறது, அதாவது மற்ற உலோகங்களின் பாதுகாப்பு பூச்சு. இது குளிர் பிளாஸ்டிக் சிதைவுக்கு மிகவும் எதிர்ப்புத் தெரிவிக்கிறது, அதனால்தான் இது 100 ° C க்கு மேல் வேலை செய்கிறது.
- ஈயம் (பிபி). கதிரியக்கத்தன்மையை நிறுத்தக்கூடிய ஒரே உறுப்பு ஈயம். இது ஒரு தனித்துவமான உறுப்பு ஆகும், அதன் தனித்துவமான மூலக்கூறு நெகிழ்வுத்தன்மை, உருகுவதற்கான எளிமை மற்றும் கந்தக அல்லது ஹைட்ரோகுளோரிக் போன்ற வலுவான அமிலங்களுக்கு ஒப்பீட்டு எதிர்ப்பு.
- தகரம் (Sn). கனமான மற்றும் எளிதான உலோகம் ஆக்சிஜனேற்றம், அரிப்புக்கு எதிர்ப்பை வழங்க பல உலோகக்கலவைகளில் பயன்படுத்தப்படுகிறது. வளைந்திருக்கும் போது, அது "டின் அழுகை" என்று அழைக்கப்படும் மிகவும் சிறப்பியல்பு ஒலியை உருவாக்குகிறது.
- சோடியம் (நா). சோடியம் என்பது கடல் உப்பு மற்றும் கனிம ஹலைட்டில் காணப்படும் மென்மையான, வெள்ளி கார உலோகமாகும். இது மிகவும் எதிர்வினை, ஆக்ஸிஜனேற்றக்கூடியது, மேலும் தண்ணீரில் கலக்கும்போது வன்முறை வெளிப்புற வெப்ப எதிர்வினை உள்ளது. அறியப்பட்ட உயிரினங்களின் முக்கிய கூறுகளில் இதுவும் ஒன்றாகும்.
அல்லாத உலோகங்களின் எடுத்துக்காட்டுகள்
- ஹைட்ரஜன் (எச்). பிரபஞ்சத்தில் மிகவும் பொதுவான மற்றும் ஏராளமான உறுப்பு, இது வளிமண்டலத்தில் காணப்படும் ஒரு வாயு ஆகும் (ஒரு டைட்டோமிக் மூலக்கூறு H2) பெரும்பான்மையின் ஒரு பகுதியாக அமைகிறது கரிம சேர்மங்கள், மேலும் நட்சத்திரங்களின் இதயத்தில் இணைவதன் மூலம் எரியும். இது லேசான உறுப்பு, மணமற்றது, நிறமற்றது மற்றும் தண்ணீரில் கரையாதது.
- ஆக்ஸிஜன் (ஓ). வாழ்க்கைக்கு இன்றியமையாதது மற்றும் விலங்குகள் ஆற்றலைப் பெறுவதற்கான செயல்முறைகளுக்கு (சுவாசம்) பயன்படுத்துகின்றன, இந்த வாயு (ஓ2) மிகவும் எதிர்வினை வடிவம் ஆக்சைடுகள் உன்னத வாயுக்களைத் தவிர அவ்வப்போது அட்டவணையின் அனைத்து கூறுகளையும் கொண்டு. இது பூமியின் மேலோட்டத்தின் பாதி வெகுஜனத்தை உருவாக்குகிறது மற்றும் நீர் தோற்றத்திற்கு இன்றியமையாதது (எச்2அல்லது).
- கார்பன் (சி). அனைத்து கரிம வேதியியலின் மைய உறுப்பு, அறியப்பட்ட அனைத்து உயிரினங்களுக்கும் பொதுவானது மற்றும் 16 மில்லியனுக்கும் அதிகமான சேர்மங்களின் ஒரு பகுதி. இது இயற்கையில் மூன்று வெவ்வேறு வடிவங்களில் காணப்படுகிறது: கார்பன், கிராஃபைட் மற்றும் வைரங்கள், அவை ஒரே எண்ணிக்கையிலான அணுக்களைக் கொண்டிருக்கின்றன, ஆனால் அவை வெவ்வேறு வழிகளில் ஏற்பாடு செய்யப்பட்டுள்ளன. ஆக்ஸிஜனுடன் சேர்ந்து இது கார்பன் டை ஆக்சைடை (CO) உருவாக்குகிறது2) ஒளிச்சேர்க்கைக்கு அவசியம்.
- கந்தகம் (எஸ்). ஒரு சிறப்பியல்பு வாசனையுடன் கூடிய மென்மையான, ஏராளமான உறுப்பு, இது கிட்டத்தட்ட அனைத்து உயிரினங்களின் செயல்பாட்டிற்கும் பொதுவானது, மற்றும் எரிமலை சூழல்களில் ஏராளமாக உள்ளது. மஞ்சள் மற்றும் நீரில் கரையாத இது கரிம வாழ்க்கைக்கு இன்றியமையாதது மற்றும் தொழில்துறை செயல்முறைகளில் மிகவும் பயனுள்ளதாக இருக்கும்.
- பாஸ்பரஸ் (பி). இயற்கையில் ஒருபோதும் சொந்த மாநிலத்தில் இல்லாத போதிலும், இது பல கரிம சேர்மங்களின் இன்றியமையாத பகுதியாகும் உயிரினங்கள், டி.என்.ஏ மற்றும் ஆர்.என்.ஏ அல்லது ஏடிபி போன்றவை. இது மிகவும் வினைபுரியும் மற்றும் ஆக்ஸிஜனுடன் தொடர்பு கொண்டு ஒளியை வெளியிடுகிறது.
- நைட்ரஜன் (என்). பொதுவாக டைட்டோமிக் வாயு (என்2) இது வளிமண்டலத்தில் 78% காற்றைக் கொண்டுள்ளது மற்றும் அம்மோனியா (NH) போன்ற ஏராளமான கரிமப் பொருட்களில் உள்ளது3), ஹைட்ரஜன் அல்லது ஆக்ஸிஜனுடன் ஒப்பிடும்போது குறைந்த வினைத்திறன் வாயுவாக இருந்தாலும்.
- ஹீலியம் (அவர்). பிரபஞ்சத்தில் அடிக்கடி நிகழும் இரண்டாவது உறுப்பு, குறிப்பாக ஹைட்ரஜனின் நட்சத்திர இணைப்பின் விளைவாக, கனமான கூறுகள் எழுகின்றன. இது ஒரு பற்றி உன்னத வாயு, அதாவது, கிட்டத்தட்ட பூஜ்ஜிய வினைத்திறன், நிறமற்ற, மணமற்ற மற்றும் மிகவும் ஒளி, பெரும்பாலும் பயன்படுத்தப்படுகிறது இன்சுலேடிங் அல்லது குளிரூட்டியாக, அதன் திரவ வடிவத்தில்.
- குளோரின் (Cl). குளோரின் அதன் தூய்மையான வடிவத்தில் விரும்பத்தகாத வாசனையுடன் மிகவும் நச்சு மஞ்சள் நிற வாயு (Cl) ஆகும். இருப்பினும், இது இயற்கையில் ஏராளமாக உள்ளது மற்றும் பல கரிம மற்றும் கனிம பொருட்களின் ஒரு பகுதியாகும், அவற்றில் பல வாழ்க்கைக்கு அவசியமானவை. ஹைட்ரஜனுடன் சேர்ந்து, இது ஹைட்ரோகுளோரிக் அமிலத்தை (எச்.சி.எல்) உருவாக்குகிறது, இது மிகவும் சக்திவாய்ந்த ஒன்றாகும்.
- அயோடின் (நான்). ஆலஜன்களின் குழுவின் உறுப்பு, இது மிகவும் எதிர்வினை மற்றும் எலக்ட்ரோநெக்டிவ் அல்ல, இருப்பினும் இது மருத்துவத்திலும், புகைப்படக் கலைகளிலும், ஒரு நிறமாகவும் பயன்படுத்தப்படுகிறது. உலோகம் அல்லாததாக இருந்தாலும், இது ஆர்வமுள்ள உலோக பண்புகளைக் கொண்டுள்ளது மற்றும் பாதரசம் மற்றும் கந்தகத்திற்கு வினைபுரியும்.
- செலினியம் (சே). நீர் மற்றும் ஆல்கஹால் கரையாதது, ஆனால் ஈதர் மற்றும் கார்பன் டிஸல்பைடுகளில் கரையக்கூடியது, இந்த உறுப்பு ஒளிமின்னழுத்த பண்புகளைக் கொண்டுள்ளது (இது ஒளியை மின்சாரமாக மாற்றுகிறது) மற்றும் கண்ணாடி உற்பத்தியில் தேவையான பகுதியாகும். இது அனைத்து வகையான உயிர்களுக்கும் ஒரு ஊட்டச்சத்து ஆகும், இது பல அமினோ அமிலங்களுக்கு இன்றியமையாதது மற்றும் பல உணவுகளில் உள்ளது.